関節リウマチの治療 - 薬物療法
関節リウマチの治療 – 薬物療法
生物学的製剤・BS
- 生物学的製剤とは
-
生物学的製剤は、化学的に合成してつくられた薬剤ではなく、遺伝子組み換え技術を用いて細胞培養など生物学的技法によりつくられた薬剤のことです。つくられる過程は合成薬に比べて複雑で、手間や費用がかかります。生物学的製剤は蛋白質で、われわれのからだにある抗体や受容体、あるいは細胞表面の分子などと同様の構造をもっており(図1)、関節リウマチをはじめとする多くの病気の治療において用いられています。
図1.生物学的製剤はどのように働くか?
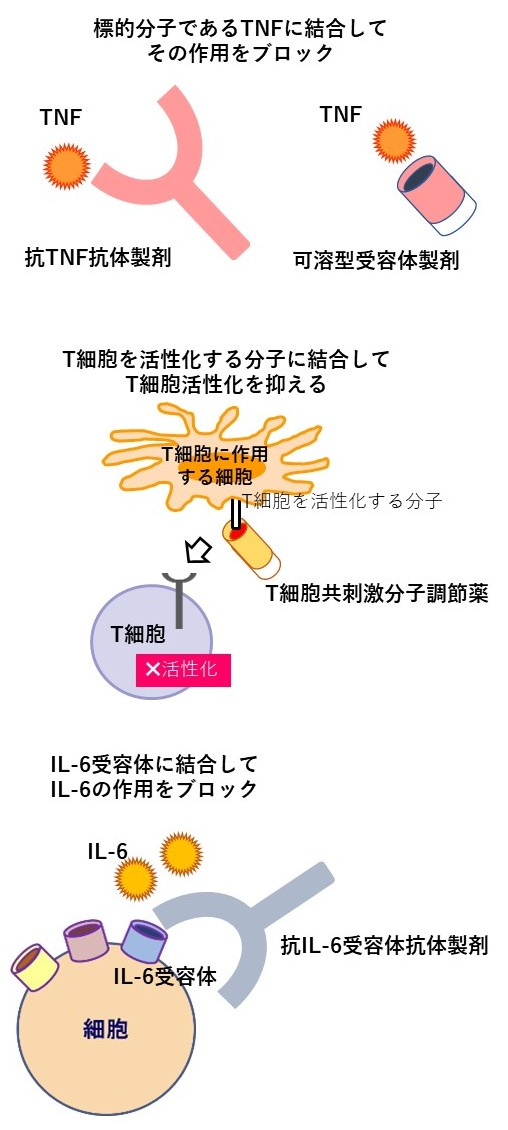
関節リウマチで使用される生物学的製剤は、大きく分けると、サイトカインと呼ばれる細胞からつくられ炎症を引き起こす蛋白であるTNFやIL-6を標的としてこれらを抑える薬剤(それぞれTNF阻害薬、IL-6阻害薬)、リウマチの免疫異常を引き起こすリンパ球のひとつであるT細胞を抑える薬剤(T細胞共刺激分子調節薬)の3種類に分けられます(図2)。
図2.生物学的製剤の作用
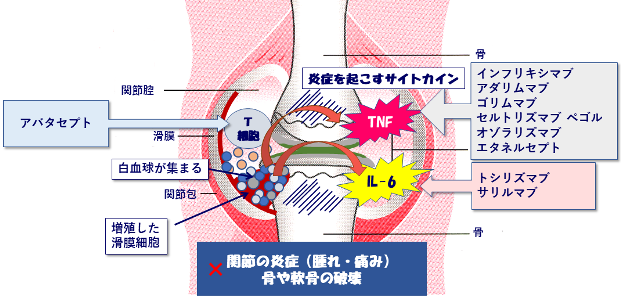
リウマチの関節には白血球が集まり、TNFやIL-6といった炎症を起こすサイトカインという物質を過剰に出している。また破骨細胞という骨を壊す細胞がTNFやIL-6によって作られて骨を壊し、炎症によって軟骨も壊されてしまう。
TNF阻害薬やIL-6阻害薬はそれぞれ、TNF、IL-6を直接抑える作用がある。またアバタセプト(商品名オレンシア)は白血球のひとつであるT細胞を抑えて、サイトカインが作られないようにする。これらの作用により炎症や関節の破壊が抑えられると考えらている。
現在は9つの生物学的製剤が使用されており、TNF阻害薬が6剤(インフリキシマブ、アダリムマブ、ゴリムマブ、セルトリズマブ ペゴル、オゾラリズマブ、エタネルセプト)、IL-6阻害薬が2剤(トシリズマブ、サリルマブ)、T細胞共刺激分子調節薬が1剤(アバタセプト)となっています(表)。さらに、インフリキシマブ、アダリムマブ、エタネルセプトについてはバイオシミラー(後発バイオ医薬品)も使用されています。
表.生物学的製剤の種類
TNF阻害薬
横にスクロールしてご覧ください
薬剤名(商品名) 製剤 投与方法 投与間隔 用量調節 BS その他 インフリキシマブ
(レミケード®)抗TNFα抗体 点滴 0, 2, 6週その後、6-8週間隔 1回3mg /kgで開始し、4回目以降にから、8週間隔なら10mg /kgまで、6週間隔なら6㎎/kgまで増量可 あり MTX併用が必須 アダリムマブ
(ヒュミラ®)抗TNFα抗体 皮下注射 2週に1回 1回40m、効果不十分な場合1回80mgに増量可 あり ゴリムマブ
(シンポニー®)抗TNFα抗体 皮下注射 4週に1回 MTX併用ありの場合 1回5、効果不十分な場合100mgに増量可
併用なしの場合100mgなし セルトリズマブペゴル
(シムジア®)抗TNFα抗体 皮下注射 0,2,4週、その後2週に1回 4週まで1回400㎎、以後1回200㎎ 症状安定期は4週に1回400mgでも可 なし 胎児への移行が少ない オゾラリズマブ
(ナノゾラ®)抗TNFα抗体 皮下注射 4週に1回 1回30mg なし ナノボディ エタネルセプト
(エンブレル®)可溶型TNF受容体 皮下注射 週1回もしくは週2回 週1回25~50mg
週2回10~25mgあり 胎児への移行が少ない ( )内は商品名
BS:バイオシミラー
MTX:メトトレキサートIL-6阻害薬
横にスクロールしてご覧ください
薬剤名(商品名) 製剤 投与方法 投与間隔 用量調節 BS その他 アクテムラ
(トシリズマブ®)抗IL-6受容体抗体 点滴もしくは皮下注射 点滴 4週に1回
皮下注射 2週に1回点滴1回8㎎/㎏
皮下注射1回162mg、効果不十分な場合は週1回に短縮可なし サリルマブ
(ケブザラ®)抗IL-6受容体抗体 皮下注射 2週間に1回 1回200㎎
150㎎に減量可なし ( )内は商品名
BS:バイオシミラー
MTX:メトトレキサートT細胞共刺激分子調節薬
横にスクロールしてご覧ください
薬剤名(商品名) 製剤 投与方法 投与間隔 用量調節 BS その他 アバタセプト
(オレンシア®)CTLA4 点滴もしくは皮下注射 0, 2 4週、以後4週に1回点滴、点滴1回、同日より週1回皮下注射もしくは週1回皮下注射 点滴体重60㎏未満 1回500㎎
60㎏以上750㎎
皮下注射1回125㎎なし ( )内は商品名
BS:バイオシミラー
MTX:メトトレキサート生物学的製剤は皮下注射あるいは点滴で投与され、投与間隔は薬剤や投与法などにより様々です。皮下注射の場合は病院に行かずに患者さん自身で行う自己注射が可能となっています。
生物学的製剤は特別な薬ではなく、日本では2003年にレミケードが生物学性製剤として初めて関節リウマチに承認され、以来、長きにわたって生物学的製剤が使用されており、現在では多くのリウマチ患者さんに日常的に使用されています。令和5年1月更新
- どのような効果が期待できますか?
-
生物学的製剤を使用すると、主に2つの効果が期待できます。
ひとつは、関節の炎症を抑える効果です。この効果は従来の抗リウマチ薬に比べて、投与開始から短い期間でみられます。炎症が抑えられれば関節の痛みや腫れはよくなり、関節を使いやすくなり、日常生活も送りやすくなります。生物学的製剤を開始すると約7割程度の患者さんがほとんど炎症や症状がない寛解もしくは低疾患活動性の状態になるとされています。発病から何年もたってから生物学的製剤を開始するよりも、早期に開始したほうがこの効果は大きいことが知られています。
もうひとつの効果は、関節リウマチの進行により起こってくる関節の骨や軟骨の破壊を抑える効果です。すなわち、生物学的製剤を早期から用いることで、関節の状態を発病前のままにできる可能性があります。
その他、生物学的製剤を使用することで、ステロイド薬や痛み止めをやめることができる、関節リウマチでみられる骨粗鬆症を抑えることができる、などの効果が期待できます。令和5年1月更新
- どのような副作用がありますか?
-
生物学的製剤はもともと体内にある蛋白とほぼ同じ構造であるため、肝臓や腎臓への影響はほとんどありません。生物学的製剤で、もっとも注意が必要な副作用は感染症です。特に結核を含めた細菌感染には注意が必要です。生物学的製剤の開始前には、胸部レントゲンやCT検査、結核の血液検査、肝炎ウイルスの検査などを行い、感染症やそのリスクがないかを評価します。活動性の感染症がある場合には生物学的製剤は投与できません。感染症のリスクに応じて結核やニューモシスチス肺炎の治療薬を予防的に投与することがあります。また、肺炎球菌ワクチンやインフルエンザワクチンなどの接種が推奨されます。
重篤な感染症でもっとも多いのが肺炎です。その他の感染症として、皮膚の感染症(蜂窩織炎、帯状疱疹など)、腎盂腎炎、腸管の感染症などがあります。発熱(特にふるえを伴う)、咳や痰、腹痛、皮膚が赤くなる、皮膚に痛みがある、などの症状があれば早めに医療機関に相談、受診することが必要です。高齢、肺の病気、ステロイド内服、リウマチの経過が長い、身体機能の障害が強い、糖尿病、などがあると肺炎など感染症のリスクが高くなるとされています。
点滴製剤では、投与中や投与後早期に発熱、皮膚のかゆみ、血圧の低下、呼吸困難などがみられることがあります。レミケードでは特に注意が必要です。皮下注射では、注射した部位が赤くなったり、腫れたりすることがありますが、大きな問題になることはほとんどありません。その他、TNF阻害薬は、うっ血性心不全、脱髄性疾患がある患者さんには投与できません。令和5年1月更新
- いつからはじめるべきですか?
-
通常は、メトトレキサートなど従来の抗リウマチ薬で治療しても、3-6か月以内に寛解といわれるほとんど症状がない状態、もしくはそれに近い状態にならない場合、生物学的製剤の追加を検討します。特にTNF阻害薬はメトトレキサートとの併用で効果が大きいことが知られています。生物学的製剤は、リウマチの症状が悪くなりどうしようもなくなってから開始するのではなく、炎症による症状が続いていれば、リウマチが進行する前のなるべく早い時期に開始すべき薬剤です。
令和5年1月更新
- 途中でやめられますか?
-
生物学的製剤をやめると、リウマチがまた悪くなる可能性があります。また生物学的製剤の種類によっても異なり、これまで中止に関する報告が多いのはTNF阻害薬です。やめるにあたっては、リウマチがしばらくの間、寛解の状態であることが望ましいとされています。しかし、そのような状態でTNF阻害薬をやめた場合でも、5年間で約8割の患者さんでリウマチの悪化がみられたことが報告されています。但し、その場合でも、TNF阻害薬を再開すれば、多くの患者さんで再びよい状態になるとされています。また、TNF阻害薬を完全にやめるよりも、投与量の調節が可能な薬剤では量を減らして継続したほうがリウマチの進行が抑えられ、悪化も起こしにくいことが知られています。
生物学的製剤の中止に関しては、上記について理解したうえで、主治医とよく相談することが必要です。令和5年1月更新
- 高い薬だと聞いていますが、どれくらいかかるのでしょうか?
-
高額な薬ですが、生物学的製剤を使ってリウマチの症状や進行を抑えることにより、これまで同様に働けるようになったり、将来、関節の手術を受けずにすむようになる可能性があります。費用は薬剤ごと、あるいは同じ薬剤でも投与量によって異なりますが、医療保険の3割負担で月に2万~3万円台となる場合が多いです。バイオシミラー(後発バイオ医薬品)は先発品の6割の薬剤費となります。医療費の負担が減る高額療養費制度が適応される可能性もありますので、現在加入されている健康保険組合やお住まいの市区町村、あるいは通院されている病院の相談窓口等にお問い合わせください。
令和5年1月更新
- 生物学的製剤を変更することはあるのですか?
-
生物学的製剤の効果が不十分な場合は、別の生物学的製剤に変更することがあります。残念ながら、どの生物学的製剤がその患者さんに最も効果があるのかを事前に知ることはできません。通常は3カ月ほど使用しても効果が不十分であれば、別の生物学的製剤に切り替えます。また、開始してしばらくは効果があっても使用していくうちに効果が弱くなってしまう場合があります。これは、からだの免疫システムが生物学的製剤を異物として捉えて排除してしまうためです。TNF阻害薬のレミケードでみられやすいとされています。この場合も生物学的製剤の切り替えが必要となります。また、生物学的製剤の無効例では、最近はJAK阻害薬が用いられることがあります。
令和5年1月更新
- 妊娠と授乳時の使用は?
-
生物学的製剤を妊娠中も継続するかについては主治医との相談が必要ですが、これまで妊娠中に生物学的製剤を使用したことで、明らかに奇形や流産等が増えるということはありません。生物学的製剤のなかで、特にTNF阻害薬について最も多くの安全性に関する報告があり、なかでも、シムジア、エンブレルは胎盤、胎児への薬剤の移行が少ないことが知られており、より安全性が高いと考えられています。メトトレキサートは奇形を起こす可能性があり妊娠中に使用できないことから、メトトレキサート併用が必要であるレミケードは妊娠中継続できません。妊娠の希望がある場合は治療薬の選択にも関連するため、事前に主治医に伝えて相談しておくことが重要です。また、TNF阻害薬は妊娠中に継続した場合、胎児に移行して出産後の免疫機能に影響を与える可能性があるため、乳児の生ワクチン(BCGやロタウイスルワクチン)の接種時期は生後6か月以降にすることが推奨されています。
授乳に関して、生物学的製剤は母乳中にもわずかに移行することが知られていますが、これを飲んでも乳児に大きな影響はないと考えられています。令和5年1月更新
- 生物学的製剤の種類
-
生物学的製剤とは遺伝子組み換え技術や細胞培養技術を用いて製造した特定の分子をターゲットとして効果を示すタンパク質を有効成分とした医薬品で、すべての剤型が注射製剤となります。現在、日本で関節リウマチに使用できる生物学的製剤は12種類あります。(表1)
生物学的製剤の種類(表1)
TNF阻害剤(TNFα/β)
横にスクロールしてご覧ください
一般名 商品名(発売年) 剤型/デバイス/針の太さ 警告・禁忌 MTX併用 ①使用方法
②投与場所
③投与間隔インフリキシマブ レミケード(2002年5月) 点滴 警告:本剤投与による重篤な感染症の発現(胸部X線、CT等の検査を実施、結核感染の有無を確認)、 Infusion reactionおよび脱髄疾患の臨床症状及び/又は画像診断上の悪化、遅発性過敏症への対応、悪性腫瘍の報告のIC、本剤の治療を行う前に、非ステロイド性抗炎症剤及び他の抗リウマチ薬等の使用を十分勘案する。
禁忌:重篤な感染症、活動性結核の患者、脱髄疾患、うっ血性心不全の患者必須 ①点滴(通常2時間で短縮も可能)
②病院
③初回・2週後・6週後に投与 4~8週間間隔インフリキシマブバイオシミラー インフリキシマブBS(2014年 11月) エタネルセプト エンブレル皮下注用(2005年3月)
エンブレル皮下注シリンジ(2008年6月)
エンブレル皮下注ペン(2013年6月)
エンブレルクリックワイズ(2022年2月)皮下注
(バイアル、シリンジ、ペン、クリックワイズ)
ボタン式/27G警告:本剤投与による重篤な感染症の発現(胸部X線、CT等の検査を実施、結核感染の有無を確認)、脱髄疾患の臨床症状・画像診断上の悪化、悪性腫瘍の報告のIC、本剤の治療を行う前に、非ステロイド性抗炎症剤及び他の抗リウマチ薬等の使用を十分勘案する。
禁忌: 敗血症の患者又はそのリスクを有する患者、重篤な感染症、活動性結核の患者、脱髄疾患、うっ血性心不全の患者必須ではない ①皮下注(自己注)
②病院 自宅(皮下注)
③週1〜2回エタネルセプトバイオシミラー エタネルセプトBS(2018年5月) アダリムマブ ヒュミラ 皮下注シリンジ(2008年6月)
ヒュミラ皮下注ペン(2018年 6月)皮下注(シリンジ、ペン)
ボタン式/29G警告:本剤投与による重篤な感染症の発現(胸部X線、CT等の検査を実施、結核感染の有無を確認)、脱髄疾患(多発性硬化症等)の臨床症状・画像診断上の新たな発生もしくは悪化、悪性腫瘍の報告のIC、本剤の治療を行う前に、少なくとも1剤の抗リウマチ薬等の使用を十分勘案する。
禁忌:重篤な感染症(敗血症等)の患者、活動性結核の患者、脱髄疾患、うっ血性心不全の患者必須ではない ①皮下注(自己注)
②病院、自宅(皮下注)
③2週間間隔アダリムマブバイオシミラー アダリムマブBS(2021年2月) ゴリムマブ シンポニー皮下注シリンジ(2011年9月)
シンポニー皮下注オートインジェクター(2019年 5月)皮下注(シリンジ、オートインジェクター)
ボタン式/27G警告:本剤投与による重篤な感染症の発現(胸部X線、CT等の検査を実施、結核感染の有無を確認)、脱髄疾患(多発性硬化症等)の臨床症状・画像診断上の新たな発現、悪性腫瘍の報告のIC、本剤の治療を行う前に、少なくとも1剤の抗リウマチ薬等の使用を十分勘案する。本剤の治療を行う前に、ステロイド又は免疫調節剤等の使用を十分勘案する
禁忌:重篤な感染症、活動性結核の患者、脱髄疾患、うっ血性心不全の患者必須ではない ①皮下注(自己注)
②病院、自宅(皮下注)
③4週間間隔セルトリズマブ ペゴル シムジア皮下注シリンジ(2013年3月)
シムジア皮下注200㎎オートクリックス(2018年 11月)皮下注(シリンジ、オートクリックス)
ボタンレス/25G警告:本剤投与による重篤な感染症の発現(胸部X線、CT等の検査を実施、結核感染の有無を確認)、脱髄疾患(多発性硬化症等)の臨床症状・画像診断上の新たな発現、悪性腫瘍の報告のIC、本剤の治療を行う前に、少なくとも1剤の抗リウマチ薬等の使用を十分勘案する。
禁忌:重篤な感染症、活動性結核の患者、脱髄疾患、うっ血性心不全の患者必須ではない ①皮下注
②病院、自宅(皮下注)
③初回・2週後・4週後に投与 2〜4週間間隔オゾラリズマブ ナノゾラ皮下注30mgシリンジ(2022年 12月) 皮下注(シリンジ) 警告:本剤投与による、結核、肺炎、敗血症を含む重篤な感染症及び脱髄疾患、悪性腫瘍の発現報告のIC、本剤の治療を行う前に、少なくとも1剤の抗リウマチ薬等の使用を十分勘案する。
禁忌:重篤な感染症(敗血症等)の患者、活動性結核の患者、脱髄疾患(多発性硬化症等)及びその既往歴のある患者
禁忌:重篤な感染症、活動性結核の患者、脱髄疾患、うっ血性心不全の患者必須ではない ①皮下注
②病院、自宅(皮下注)
③4週間の間隔IL-6シグナル遮断薬
横にスクロールしてご覧ください
一般名 商品名(発売年) 剤型/デバイス/針の太さ 警告・禁忌 MTX併用 ①使用方法
②投与場所
③投与間隔トシリズマブ アクテムラ点滴(2005年6月)
アクテムラ皮下注シリンジ・オートインジェクター(2013年 5月)点滴
皮下注(シリンジ、オートインジェクター)
ボタン式/27G警告:感染症(胸部X線、CT等の検査を実施)、本剤の治療を行う前に、少なくとも1剤の抗リウマチ薬の使用を十分勘案する(点滴製剤のみ)。
禁忌:重篤な感染症、活動性結核の患者必須ではない ①点滴(1時間点滴)、皮下注(自己注)
②病院、自宅(皮下注)
③4週間間隔(点滴) 1~2週間間隔(皮下注)サリルマブ ケブザラ皮下注シリンジ(2018年 2月)
ケブザラ皮下注オートインジェクター(2018年 12月)皮下注(シリンジ、オートインジェクター)
ボタンレス/27G警告:感染症(胸部X線、CT等の検査を実施)、本剤の治療を行う前に、関節リウマチの既存治療薬の使用を十分勘案する。
禁忌:重篤な感染症、活動性結核の患者必須ではない ①皮下注(自己注)
②病院、自宅(皮下注)
③2週間間隔CD8/86阻害剤(CTLA4)
横にスクロールしてご覧ください
一般名 商品名(発売年) 剤型/デバイス/針の太さ 警告・禁忌 MTX併用 ①使用方法
②投与場所
③投与間隔アバタセプト オレンシア点滴(2010年9月)
オレンシア皮下注シリンジ(2013年8月)
オレンシア皮下注オートインジェクター(2016年5月)点滴
皮下注(シリンジ、オートインジェクター)
ボタン式/27G警告:重篤な感染症の発現に注意、悪性腫瘍の報告のIC、本剤の治療を行う前に、少なくとも1剤の抗リウマチ薬等の使用を十分勘案する。
禁忌:重篤な感染症の患者必須ではない ①点滴(30分点滴)、皮下注(自己注)
②病院、自宅(皮下注)
③点滴:初回・2週・4週後に投与 4週間間隔 皮下注:週1回まず、代表的な医薬品として腫瘍壊死因子(TNF)という分子と結合してその作用を抑制する医薬品が6種類あります。キメラ型抗TNFモノクローナル抗体(マウス蛋白を25%含有)であるインフリキシマブ、可溶性TNFレセプターとヒトIgGとの融合蛋白であるエタネルセプト、完全ヒト型抗TNFモノクローナル抗体のアダリムマブ、ゴリムマブ、ペグ化したセルトリズマブペゴル、およびナノボディ製剤であるオゾラリズマブで、それぞれレミケード®、エンブレル®、ヒュミラ®、シンポニー®、シムジア®、ナノゾラ®という商品名で使用されています。この中で、現在バイオシミラーとして、インフリキシマブ、エタネルセプト、アダリムマブの3種類のみが発売されています。
また、IL-6(インターロイキン-6)のレセプターに対する抗体製剤にはトシリズマブとサリルマブの2種類があり、それぞれアクテムラ®とケブザラ®という商品名で使用されています。
さらに、抗原提示細胞とT細胞間の共刺激シグナルを阻害し、関節リウマチの発症に関与するT細胞の活性化を抑制するのがアバタセプトで、オレンシア®という商品名で使用されています。(図1)
これらの生物学的製剤は、従来の抗リウマチ薬に比べて強力な骨破壊抑制作用に加え、抗炎症効果が早期に認められるため、現在多くの患者さんに使用されております。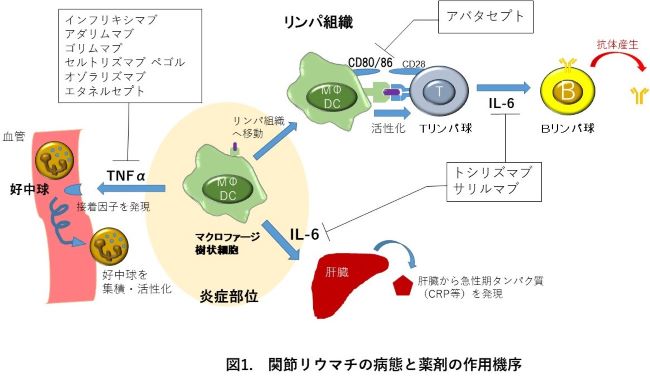
各種生物学的製剤の特徴
①抗ヒトTNFαモノクローナル抗体製剤
TNFαは関節リウマチ(RA)の関節炎や骨の破壊に関係している重要な分子です。関節リウマチでは、このTNFという免疫に関連する物質が過剰につくられ、炎症や関節の破壊を引き起こす主要な原因となることが知られています。したがって、この働きを阻害することにより関節の痛みや腫れが軽くなり、さらに骨の破壊が抑制されて、将来関節が変形するのを防ぐことができます。
このTNFを標的として直接その働きを抑えるTNF阻害薬は、もともとヒトのからだに存在する抗体や受容体などのタンパク質を生物学的な手法を用いて人工的に作った薬物です。TNF阻害薬はすでに関節リウマチ治療に用いられ、関節症状を抑えるだけでなく、骨や軟骨破壊の予防作用があり、高い有効性が認められています。
TNFαを阻害するRAの治療薬としては、日本でも既に2003年7月にインフリキシマブ(商品名:レミケード®)、2005年3月にエタネルセプト(商品名:エンブレル®)が発売され使用されています。アダリムマブ(商品名:ヒュミラ®)は3番目のTNFα阻害薬として2008年4月に承認されました。いずれの薬剤も関節炎を抑える効果は強力で、RA治療の基本的薬剤であるメトトレキサート製剤(以下MTX、商品名:リウマトレックス、メトレートなど)で効果が不十分な患者さんに、これらの抗TNF製剤のいずれかを併用すれば、関節炎の症状が治まるだけでなく、骨の破壊を抑えることによって将来の関節の変形も防止できることが報告されています。インフリキシマブ(レミケード®、インフリキシマブBS)
インフリキシマブは点滴製剤で、基本的には初回投与後、2週、6週に投与し、以後8週間の間隔で投与を行う製剤で、 MTX が無効ないし効果不十分な患者さんにMTXと併用することになっています。通常開始して1~2週間で炎症反応(CRPなど)が改善し、痛みや関節の腫れも引いてきます。また骨破壊の進行も止めることが分かっており、将来の関節の変形を予防できることが期待できます。また、改善した後で中止しても良い状態(寛解)が維持できる場合があり、ほぼ治癒に近い状態に導ける可能性もあります。
インフリキシマブはキメラ型モノクローナル抗体で、TNFαと結合する部位のみがマウスの蛋白からなり、その他はヒト由来の蛋白で、遺伝子工学によって2種の蛋白を合体したものです。全体の25%がマウス蛋白なので、ヒトにとっては本来の体にはない異物と認識されるために、アレルギー反応がおこることがあります。このためアナフィラキシー(急性のアレルギー反応で血圧の低下やショック状態を起こす)と呼ばれる、生命にも関わる可能性がある強いアレルギー反応も0.5%程度ですが起こり得ます。また連用しているとインフリキシマブに対する抗体(抗キメラ抗体)ができて、効果が減弱してくることがしばしばあります。このアレルギー反応や抗キメラ抗体の産生を抑えるためにMTXと必ず併用します。したがって、MTXがどうしても服用できない患者さんはインフリキシマブも使用できません。エタネルセプト(エンブレル®、エタネルセプトBS)
エタネルセプトは皮下注射製剤で 週に2回皮下注射します。半減期(体内での薬の濃度が半分になる時間)が4日と短いため、1週間に2回の注射が必要で、多くは患者さん自身がトレーニングを受けて自己注射で使用します。はじめは医師が行うことになっており、週2回の通院が必要です。以後は訓練して自己注射ができるようになれば、通院は2週に1回で済みます。
エタネルセプトはTNF受容体という蛋白とヒトの免疫グロブリンという蛋白の一部を人工的につなぎ合わせたもので、すべてヒト蛋白でできています。インフリキシマブと異なりマウス蛋白がないので抗キメラ抗体はできないため、MTXとの併用は必ずしも必要ではなく、単独でも使用できます。アナフィラキシーはほとんどありません。またMTXとの併用で、アレルギー反応も抑えられ、RAに対する効果も強くなることが知られていますので、効果を期待するならば併用する方が望ましいとされています。アダリムマブ(ヒュミラ®)
アダリムマブは皮下注射製剤でエタネルセプトに比較して半減期が長いため、注射の頻度は2週間に1回となっております。本剤もMTXとの併用は必須ではありませんが、併用した方が高い有効性が示されていることから、他の製剤と同様にMTXとの併用が推奨されています。
インフリキシマブとの違いは、マウス蛋白を含まないことと、皮下注製剤であることです。このためMTXは併用不要で単独での使用が認められています。しかしマウス蛋白を含まなくても、中和抗体(抗アダリムマブ抗体)が認められた報告もあり、効果の減弱やアレルギー反応がみられる可能性があります。ゴリムマブ(シンポニー®)
ゴリムマブはインフリキシマブ、エタネルセプト、アダリムマブに続く国内で4番目となるTNF阻害薬です。本剤はMTX併用時は1回50mgを、MTXが併用されていない場合や、併用していても50mgで効果が不十分なときには100mgを、4週に1回皮下注射で投与します。他のTNF阻害薬と同様に、MTXと併用したほうがより強い効果がみられます。
セルトリズマブペゴル(シムジア®)
セルトリズマブペゴルは、関節リウマチに対して適応となった5番目のTNF阻害薬です。通常、成人にはセルトリズマブペゴルとして、1回400mgを初回、2週後、4週後に皮下注射し、以後1回200mgを2週間の間隔で皮下注射し、症状安定後には、1回400mgを4週間の間隔で皮下注射できる製剤です。
本剤はヒト化TNFモノクローナル抗体のFab’断片(抗体分子のFc部分を切り離したもの)をポリエチレン・グリコール(PEG)という化学物質と結合させた特殊な製剤です。すなわちセルトリズマブペゴルは今までのTNF阻害剤と異なる3つの構造上の特徴があります。①PEG化、②Fc部分がない、③1価(1分子の抗原とのみ結合可能)の3つです。
特に部位が無いことは胎盤を通過することができないため胎児にはほとんど影響がないこと、さらに乳汁移行性も低いと言われており、妊婦や授乳婦にも胎児や新生児への影響がなく投与できる可能性があります。
Fc部位がないことから肥満細胞からの脱顆粒も理論的に起こらないため、投与部位反応の緩和につながると期待されています。オゾラリズマブ(ナノゾラ®)
オゾラリズマブは、関節リウマチに対して適応になった6番目のTNF阻害剤ですが、従来のIgG抗体ではなく、ナノボティ製剤です。通常の抗体は重鎖と軽鎖それぞれ2本が結合した形であるのに、ナノボディは重鎖のみで構成されていて通常のIgG抗体の1/10の大きさです。オゾラリズマブは、2種類の抗TNFαナノボディと抗血清アルブミンナノボディを組み合わせた構造になります。通常の抗体製剤の1/4の大きさになり、従来のTNF抗体製剤より小さいために、関節炎部位へ早く到達し、かつ高濃度に集積することが期待されています。また他のTNF抗体が利かなくなった場合(二次無効)でも、オゾラリズマブは有効な例があることが報告されています。
投与方法は、1回30mgを4週間隔で皮下注射します。MTXを一緒に服用しなくても、服用したときと同程度の有効性が示されています。②ヒト化抗ヒトIL-6レセプターモノクローナル抗体
トシリズマブ(アクテムラ®)
本剤は炎症を引き起こす物質であるIL-6の活性を抑制することで関節の炎症を改善し、全身症状(関節変形・破壊から生じる機能障害、疲労、貧血、骨粗鬆症など)を緩和します。国内の臨床試験では、MTXの使用で効果が不十分な症例に対して、トシリズマブは単独投与でも有効性を示しております。
トシリズマブには点滴製剤と皮下注製剤があります。点滴製剤は4週間に1回点滴し、皮下注製剤は通常2週間に1回の投与ですが、効果が不十分な場合には1週間まで投与間隔を短縮できます。
血液検査所見上、感染症が起こっても、CRP値の上昇がみられないことから発見が遅れることが危惧されているため注意が必要な薬剤です。サリルマブ(ケブザラ®)
本剤はヒト型抗IL-6 受容体モノクローナル抗体製剤 であり、関節液中や血液中に過剰に存在しているIL-6という物質の代わりに受容体に結合することで、IL-6 の働きを抑え、関節の腫れや痛みを改善し、関節破壊の進行を抑制することが期待されます。
サリルマブの投与方法は、通常、成人には2週間隔で皮下に注射します。通常用量は200mgですが、好中球減少症や肝機能障害等の状態に応じて150mgを選択することがあります。
注意すべき重篤な副作用として、第一に感染症があげられます。
血液検査所見上、感染症が起こっても、CRP値の上昇がみられないことから発見が遅れることが危惧されます。③T細胞選択的共刺激調節剤
アバタセプト(オレンシア®)
アバタセプトはこれまでの抗ヒトTNFαモノクローナル抗体製剤や抗ヒトIL-6レセプターモノクローナル抗体製剤とは異なる新しい作用機序を有する生物学的製剤です。本剤は抗原提示細胞とT細胞間の共刺激シグナルを阻害し、関節リウマチの発症に関与するT細胞の活性化を抑制することから、「T細胞選択的共刺激調節薬」と呼ばれています。従来の生物学的製剤と比べ、より上流で作用するのが特徴で、その作用機序から従来薬では十分に効果が得られなかった症例や感染症のリスクの高い患者さんに有効とされています。
アバタセプトは点滴製剤と皮下注製剤があります。点滴製剤は 体重により1回当たり500mgから1gを初回投与後、2週、4週に投与し、以後4週間の間隔で点滴静注します。また、皮下注製剤を使用する際は、通常、成人には投与初日に負荷投与としてアバタセプト点滴静注用製剤の点滴静注を行った後、同日中に本剤125mgの皮下注射を行い、その後、本剤125mgを週1回、皮下注射しますが、本剤125mgの週1回皮下注射から開始することもできます。これら生物学的製剤にはいくつかの注意すべき副作用がありますが、特に重要なものは感染症とアレルギー反応です。その中でも結核は重要で、ツベルクリン反応陽性など結核感染の既往があると思われる方は抗結核薬を服用しながらこの治療を受ける必要があります。
結核以外では、種々の病原体による肺炎が起こる可能性がありますので、咳や発熱などの症状があればすぐに主治医に連絡する必要があります。
また、B型肝炎ウイルス(HBV)キャリアの患者さんに対して生物学的製剤を投与する際には、劇症化を防ぐためRA治療開始前に核酸アナログ製剤の投与を行い、薬剤に応じて1~3カ月間に1回程度のHBV-DNAのモニタリングを行う必要があります。【情報掲載】令和5年1月 更新
- バイオシミラーとは
-
まず、ジェネリック医薬品についてご説明します。
ジェネリック医薬品(後発医薬品)とは?
先発医薬品の特許期間等が終わり、厚生労働大臣の承認後、他の医薬品メーカーが製造・販売することができるようになった医薬品のことをいいます。ジェネリック医薬品は、有効成分の構造が先発医薬品と同じであるため、有効性と安全性を評価する臨床試験は行わなくても良いとされ開発された医薬品です。
ジェネリック医薬品には服用しやすくするために味を変更したり、水なしで服用できる錠剤(口腔内崩壊錠)に改良するなど先発医薬品を改善した薬剤があります。また、添加物の異なる医薬品も多くありますが、有効成分のみならず、原薬、添加物、製法等も先発医薬品と同じであるオーソライズドジェネリックという医薬品もあります。
ジェネリック医薬品は、開発期間が新薬ほどかからないことから先発医薬品に比べて薬価が安くなるため、患者さん一人ひとりの自己負担軽減や国民医療費の削減にもつながります。では、バイオシミラーとはどのようなお薬なのでしょう。
バイオシミラーとは?
バイオシミラーは、別名「バイオ後続品」や「後発バイオ医薬品」と呼ばれ、既に国内で先行発売されている生物学的製剤(先行バイオ医薬品)とは異なる医薬品メーカーで開発された同等の医薬品のことをいいます。
バイオシミラーは、先行バイオ医薬品と有効成分の構造は全く同じではありませんが、臨床試験を含む多くのデータによって有効性・安全性に差異はないとされています。
先行バイオ医薬品と同様にバイオシミラーも遺伝子組み換え技術を用いて細胞を培養・精製して医薬品をつくるため、厳密な品質管理の中で製造されています。そのため、一般的な医薬品に比べて高額になりますが、先行バイオ医薬品に比べてバイオシミラーの方が安価なため、医療費の負担軽減に繋がります。そして、2つのお薬はどのように違うのでしょう
ジェネリック医薬品とバイオシミラーの違いについて
先行バイオ医薬品とバイオシミラーとの関係は、化学合成医薬品の先発品とジェネリック医薬品との関係とは異なります。
ジェネリック医薬品は、有効成分が完全に同じであるため有効性と安全性を確認するために臨床試験を行う必要はありません。これに対してバイオシミラーは、構造が複雑で分子量の大きい物質であるため、分子レベルで同一性を証明することは困難であり、有効性、安全性に関する同等性・同質性を検証するために、臨床試験を行うことが求められています。
ジェネリック医薬品とバイオシミラーは、そもそも開発過程が異なり、有効成分が完全に同じ成分が使用されているジェネリック医薬品に対し、バイオシミラーでは全く同一ではないことが大きな違いとなります。令和5年1月更新
